染色质免疫沉淀法(Chromatin Immunoprecipitation,ChIP)是一种基于抗原抗体反应的特异性,从而起到选择性地使DNA结合蛋白及其DNA靶标富集的作用,是在全基因组水平研究生命体组织或细胞内蛋白质与DNA相互作用的一种技术方法。近年来,随着生物技术的迅速发展,ChIP 技术不断发展和完善, 被广泛应用于体内转录调控因子与靶基因启动子上特异核苷酸序列结合方面的研究, 并成为在染色质水平研究基因表达调控的有效方法。特别是,此技术与 DNA 芯片和分子克隆技术相结合,可用于高通量筛选已知蛋白因子的未知DNA 靶位点和研究反式作用因子在整个基因组上的分布情况,这将有助于深入研究DNA 与蛋白质相互作用的调控网络。
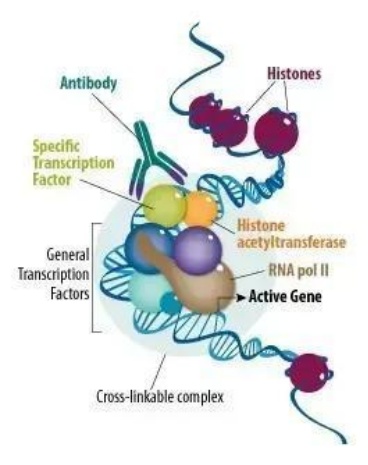
图1. 染色质免疫沉淀
技术原理:
在活细胞状态下,当用甲醛处理时,相互靠近的蛋白与蛋白、蛋白与核酸(DNA或RNA)之间会产生共价键。细胞内,当TF与Promoter相互结合时,它们必然靠的比较近或者契合在一起,这个时候用甲醛处理,能使它们之间产生共价键。固定的蛋白质-DNA复合物通过超声或酶处理将其随机切断为一定长度范围内的染色质小片段,然后通过抗原抗体的特异性识别反应沉淀此复合体,特异性地富集目的蛋白结合的DNA片段,通过对目的片断的纯化与检测,从而获得蛋白质与DNA相互作用的信息。通过qPCR或二代测序,筛选与目的蛋白互作的未知DNA信息。
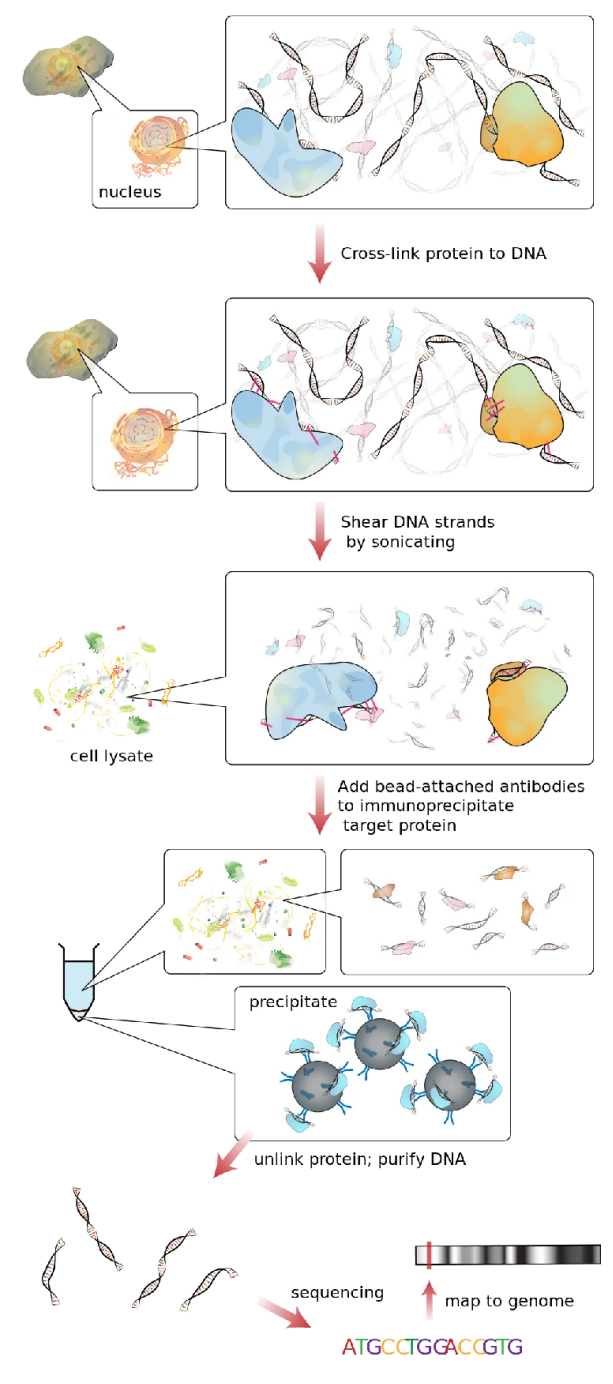
图2. 染色质免疫共沉淀原理
实验流程:
1、交联和裂解
作用:将细胞或组织进行固定(交联)与裂解。
新鲜组织或活细胞中加入甲醛,目的是稳定蛋白与DNA天然结合的状态,以免后续的实验步骤破坏这种相互作用。在固定完成后,细胞或组织进行充分裂解。
2、染色质片段化
作用:细胞核材料片段化是获得良好的 ChIP 分辨率的关键因素,理想情况下的片段大小在 200 到 800 bp对之间。剪切是最难控制的步骤之一。
将染色质打断成200-500 bp的小片段,在后续实验中,结合了目的蛋白的片段将被抗体识别而保留,没有结合目的蛋白的小片段则将被洗脱。在进行后续的实验前,一般会将打断后的样品取一部分进行解交联和DNA纯化,通过琼脂糖电泳或者毛细管电泳检测其片段化范围是否符合下游实验的需求。
注意:此时可以停 止ChIP。经过剪切/消化染色质后,可以将样品于 -80°C 储存。避免反复冻融。
3、免疫沉淀与DNA纯化
作用:此步骤通过目的蛋白的特异抗体,对“DNA-目的蛋白”复合物进行富集与洗脱。后续进行解交联与蛋白消化,最后纯化DNA分子。
IP实验除了有实验组,还应该有阳性对照、阴性对照和空磁珠组,用以质控IP实验流程是否合格。实验组加入目的蛋白对应的抗体,抗体应该选用IP级别的抗体,WB抗体不一定能满足IP实验,具体参见抗体说明。阳性对照一般选用已知的组蛋白抗体;阴性对照采用与目的蛋白抗体相同种属来源的血清;空磁珠组则不加任何抗体。
注意:此时可以停 止ChIP。经过解交联和/或 DNA 纯化后,可以将样品于 -20°C 储存。
4、定量 DNA
作用:qPCR可以对目的片段进行定量分析。通过对目的序列的扩增,并与Input、阳性对照和阴性对照的量对比,就可以证明目的蛋白是否与预想的DNA序列发生了相互作用。
ChIP-Seq 是将回收纯化的DNA进行建库测序,用于发现目的蛋白潜在结合的DNA序列。
注意事项(1) 交联:甲醛是最常用的交联剂,具有形成可逆交联的优势。然而,需控制交联时间,过长的交联时间可能导致超声波破碎困难,甚至引起蛋白质与DNA的非直接结合。此外,经甲醛固定后,消化酶可能无法再进行消化。
(2) 染色质切割:使用超声破碎时,需要优化条件以获得200–500 bp的染色质片段。影响超声破碎的因素包括样品体积、超声探头深度、超声强度和超声时间。建议在4°C条件下进行超声。核酸酶消化须严格监控时间,以防止过度消化导致的亚核体形成,这会干扰后续DNA-蛋白质互作检测。
(3) 抗体选择:选择合适的抗体对实验成功至关重要。推荐选用免疫沉淀级别(IP级别)的抗体,并根据需求选择单克隆或多克隆抗体。单抗具有较高的特异性,但识别位点单一;若目的蛋白的识别位点被其它分子阻塞,则可能无法有效识别。根据所选抗体类型,配合使用Protein A或G磁珠。
(4) 操作要点:整个实验过程应尽量在4°C下进行,以保持样本的稳定性。操作时应避免产生气泡,以防影响反应效率和结果准确性。
(5) 结果分析:获得DNA片段并不直接证明目的蛋白与DNA的直接结合。如果与目的蛋白形成复合物的其它蛋白与DNA有结合作用,也可能使DNA富集。因此,在解释结果时需考虑其他可能性。


