CRISPR(clustered regularly interspaced short palindromic repeat)系统是原核生物的获得性免疫系统,用于抵御外源入侵的病毒或质粒。2012 年,来自Ⅱ型CRISPR系的CRISPR相关蛋白Cas9被证明可以在体外由简单设计的向导RNA(single guide RNA,sgRNA)引导识别并切割含PAM(protospacer adjacent motif)序列的靶标双链DNA ;快Cas9又被成功应用于哺乳动物细胞的基因组编辑。从那时起,CRISPR技术在基因组编辑领域受到了高度重视和广泛应用,也连续多年被Science杂志列为“年度十大技术破”。此外,CRISPR技术也被用于基因表达调控、高通量筛选、表观遗传学工程等领域。

核酸检测是病原菌检测、疾病检测、用药指导等领域的重要技术。虽然,目前已经开发出了许多核酸检测的方法,但更快速、更廉价、更特异、更灵敏的技术仍然是不断追求的目标。CRISPR技术无疑提供了核酸检测领域的新的解决方案,特别是基于Cas13和Cas12的反式切割(trans cleavage)或称附带切割(collateral cleavage)的活性开发的检测技术被誉为“下一代分子快速诊断技术”。


基于Cas9 的检测系统
通过将Cas9的特异性切割特征和核酸扩增体系结合,可实现针对靶标核酸的检测,从而可实现SNP(single nucleotide polymorphism)的区分和病原体表型的分型。目前,有至少3种结合PCR扩增的检测方法被成功开发,分别为ctPCR(CRISPR-typing PCR)、CARP(Cas9/sgRNAs-associated reverse PCR)和基于CRISPR/Cas9切割活性的PCR。上述方法都是在PCR扩增之前利用Cas9切割完全匹配的靶标序列,而不切割产生突变的靶标序列,从而影响PCR的扩增结果,进而区分诸如高危人乳头瘤病毒(HPV)亚型HPV16和HPV18或是用来检测低频突变。
对于偏远地区的野外检测,常常需要无需精确循环控温仪器的等温扩增方法。结合NASBA(nucleic acid sequence based amplifi cation)介导靶标序列扩增,将Cas9、T7转录系统与基于纸质载体的等温toehold生物传感系统相结合,可实现通过肉眼观察来检测寨卡病毒的基因分型。此外,CAS-EXPAR(CRISPR/Cas9 triggered isothermal exponential amplification reaction)和CRISDA(CRISPR-Cas9-triggered nicking endonuclease mediated strand displacement amplifi cation method)方法,都使用了Cas9的切割与等温扩增相结合的策略,以达到针对靶标序列的单碱基分辨率。
基于反式切割活性的核酸检测
单链RNA反式切割活性的核酸检测系统
Cas13a 是RNA引导的RNA切割酶,属于Ⅵ型CRISPR-Cas 蛋白。在gRNA的引导下,Cas13a 结合单链靶标RNA后,除了能将靶标RNA切断之外,还可激发Cas13a的“反式切割”活性,即Cas13a随机切割体系中其他的单链RNA分子。基于Cas13a的该原理,研究人员开发了SHERLOCK(Specific High Sensitivity Enzymatic Reporter UnLOCKing)的检测系统。具体做法是利用RPA(recombinase polymerase amplification)或者RT-RPA等温扩增系统将目标模板扩增为包含T7启动子的DNA模板,然后再利用T7转录系统把DNA模板转变为Cas13a可以直接结合的RNA靶标;同时在体系中添加一端为荧光发光基团、一端为荧光淬灭基团的单链RNA报告分子;在Cas13a结合靶标RNA后即触发Cas13a随机切割单链RNA探针的活性,从而产生游离的荧光发光基团并发出可检测的荧光。利用该方法,研究人员灵敏地检测了各种DNA或RNA靶标,包括寨卡病毒、 登革热病毒、细菌分离株、抗性基因、人类DNA 基因型和癌症突变等。之后不久, 第二代SHERLOCKv2 系统被成功开发,其使用4 种正交的CRISPR-Cas 蛋白来实现多重靶标的检测。在此基础上,为了适应野外偏远地区的快速分子检测,研究人员进一步开发了HUDSON(heating unextracted diagnostic samples to obliterate nucleases)方法来直接对人的体液进行快速样本处理,然后利用SHERLOCK 方法便在不到2h 内直接从患者样本中成功检测出了登革热病毒。
单链DNA反式切割活性的核酸检测系统
除Cas13蛋白外, 来自Ⅴ 型的CRISPR-Cas12a蛋白也被发现具有反式切割特性;但与Cas13不同,Cas12a靶向DNA模板并反式切割单链DNA(singlestranded DNA,ssDNA)利用Cas12a蛋白建立的核酸快速检测方法的首次报导来自一篇2017 年提交的中国专利;后来,同一研究组在线发表了两篇研究论文,详细描述了Cas12a的切割特征和基于Cas12a的核酸检测方法,称为HOLMES(onehour low-cost multipurpose highly efficient system)。同一时期,美国一个研究组也发布了基于Cas12a的、类似的核酸检测方法,名为DETECTR(DNA endonuclease-targeted CRISPR transreporter)。无论是HOLMES还是DETECTR都展示了非常高效、灵敏和特异的检测活性,可以用来快速检测DNA病毒、RNA病毒和人的SNP。
此外,研究人员还证明了嗜热的Cas12b 同样具有反式切割活性,并成功地将其应用于核酸检测, 并命名为HOLMESv2。由于Cas12b 具有广泛的切割活性温度,该酶可以和LAMP(loop mediated isothermal amplification)等温扩增系统结合,从而能够实现一锅式核酸快速定性和定量检测。此外,由于用于LAMP扩增体系的Bst 3.0酶可利用DNA或RNA模板直接进行扩增,基于Bst 3.0 酶的HOLMESv2 可极大地简化RNA的检测程序,并在无需对RNA模板先行逆转录操作的情况下,成功实现在1h 内快速检测RNA病毒的目标。
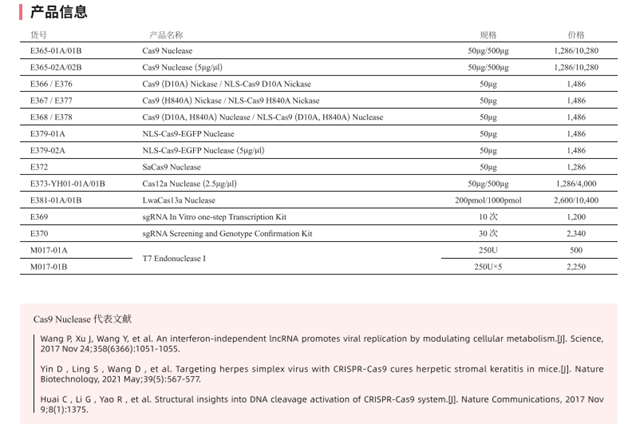
本产品仅限科研研究不做临床诊断


