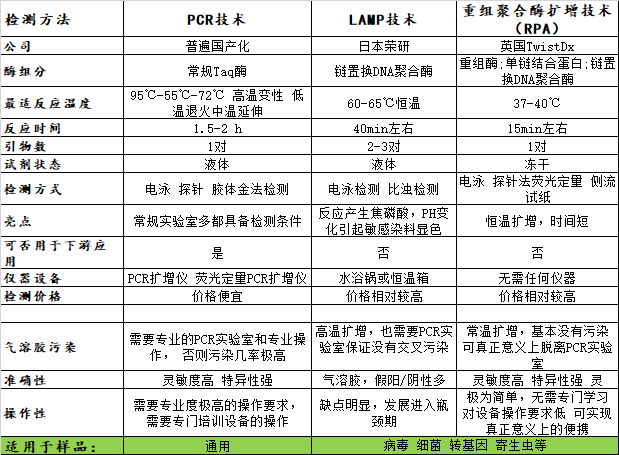
常规PCR,环介导的恒温PCR(LAMP),重组酶聚合酶扩增(RPA)三种分子扩增技术原理和对比
常规PCR
PCR即聚合酶链式反应(Polymerase chain reaction)的缩写,1983年出现的一种对已知DNA片段进行体外扩增的技术。它利用耐高温的DNA聚合酶(Taq 酶),将模板DNA,引物,脱氧核苷三磷酸(dNTP)和缓冲液等在不同温度间循环,从而达到双链DNA分离,引物粘合到模板上的互补区间,最后在DNA聚合酶作用下脱氧核苷三磷酸逐个添加到新合成的DNA链上的过程。通过PCR技术,特定DNA片段可以达到指数级别的扩增,从原来的少量DNA分子扩增到可以用仪器检测的水平,利用这一特点可以对一些特异的病原或疾病标志物进行诊断。
近几年,由于PCR技术的不断成熟,特别是实时荧光定量PCR(qPCR)的出现,使得基于qPCR的分子诊断产品日渐成为主流。但常规的PCR技术由于热循环的需要,使这一技术完全依赖于电源和昂贵的PCR仪器,从而限制了这一技术在实验室之外的应用。由于这些缺点,科学界一直在试图发展不需要使用PCR仪器的核酸扩增方法,恒温核酸扩增技术的发展成为一个不可逆转的趋势。
主要的步骤:
★DNA变性 加热使靶DNA序列双链解离成单链DNA。
★引物与靶DNA退火 适当降低温度,使两个引物分别结合成靶DNA两条的3′末端向5′末端延伸。
★引物延伸 在DNA聚合酶的催化下,引物沿着靶DNA3′末端向5′末端延伸。新合成的DNA链在变性解离后,又可作为模板与引物杂交,并且在DNA聚合酶的催化下,引导合成新的靶DNA链。如此反复进行以上3个步骤,即可使靶DNA片段指数性扩增。
环介导恒温核酸扩增(LAMP)
环介导恒温核酸扩增(LAMP)是日本学者Notomi等在2000年发表的一种核酸扩增的方法,他利用特殊的引物设计方法和恒温核酸链置换酶将少量目标DNA在60分钟内扩增到千百万份。LAMP反应中需要4-6个引物,这些引物特异性的识别模板DNA的6-8个DNA区间。在每一套LAMP的引物中,包括两个外部引物(F3和B3),两个内部引物(FIP和BIP)以及两个环导引物(loop F和loop B)。LAMP引物设计和反应原理如图1所示。

LAMP的反应混合物由dNTPs,链置换聚合酶,荧光染料,引物和DNA模板组成。用于LAMP反应的引物设计,其特征在于使用四种不同的引物,这些引物是专门设计用于识别靶DNA的六个不同区域的。前内引物(FIP)由3' 末端的F2区和5' 末端的F1c区组成;正向外引物(F3引物)由F3区组成,其与模板序列的F3c区互补;向后内部引物(BIP)由3' 末端的B2区域和5' 末端的B1c区域组成。向后外引物(B3引物)由B3区组成,其与模板序列的B3c区互补。当FIP的F2区与靶DNA的F2c区杂交并启动互补链合成时,扩增开始,然后F3引物与靶DNA的F3c区域杂交并延伸,取代FIP连接的互补链。该置换链在5' 末端形成环,这种在5' 末端具有环的单链DNA然后用作BIP的模板,B2与模板DNA的B2c区域杂交,启动DNA合成,导致形成互补链并打开5' -末端环,随后,B3与靶DNA的B3c区域杂交并延伸,置换BIP连接的互补链,这导致形成哑铃形DNA。通过Bst DNA聚合酶将核苷酸添加到F1的3' 末端,其在5' 末端延伸并打开环,哑铃形DNA现在转变为茎环结构(参见a和b)。该结构用作LAMP循环的引发剂,其是LAMP反应的第二阶段。也可以添加环引物用于LAMP的指数扩增,获得的最终产品是具有不同茎长度的茎环DNA和具有多个环的各种类似于菜花的结构的混合物。
重组酶聚合酶扩增(RPA)
重组酶聚合酶扩增(RPA),被称为是可以替代PCR的核酸检测技术。RPA技术主要依赖于三种酶:能结合单链核酸(寡核苷酸引物)的重组酶、单链DNA结合蛋白(SSB)和链置换DNA聚合酶。这三种酶的混合物在常温下也有活性,最佳反应温度在37℃左右。重组酶与引物结合形成的蛋白-DNA复合物,能在双链DNA中寻找同源序列。一旦引物定位了同源序列,就会发生链交换反应形成并启动DNA合成,对模板上的目标区域进行指数式扩增。被替换的DNA链与SSB结合,防止进一步替换。在这个体系中,由两个相对的引物起始一个合成事件(见图2)。整个过程进行得非常快,一般可在十分钟之内获得可检出水平的扩增产物 (Piepenburg等,2006)。
RPA不但可以快速扩增,还支持在同一个管中同时进行多个扩增反应。不过,多重化的引物组合需要精心设计,以便每个引物都能同样有效的工作。需要注意的是,RPA反应的引物总量(nmol)最好不要超标太多。如果在一个反应中使用两个以上的扩增引物,就应该控制不同引物的量。另外,检测多个扩增事件的探针、设备以及荧光物质的兼容性都需要提前考虑。RPA还可以对模板进行定量。因为扩增产物达到可检出水平的时间,是依赖于反应起始时的模板量。初始模板的拷贝越多,扩增产物就越快达到可检出水平。不过,这种定量需要精心的实验安排,确保对照反应是同时开始的。举例来说,可以利用镁离子的添加时间进行控制。因为镁离子一旦进入体系,RPA反应就会开始。此外,较慢的扩增过程有助于更精确的定量。我们可以通过调整反应条件或引物设计来减慢RPA的反应速度。目前大多数RPA相关产品还是由英国的Twist Dx开发的。
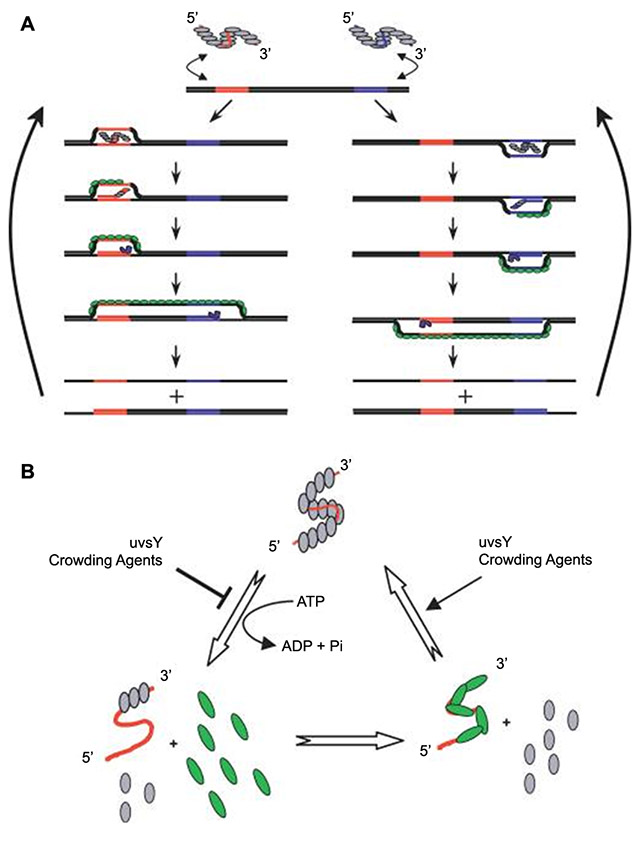
重组酶/引物复合物寻找模板DNA的同源序列(红色/蓝色)。链交换后,置换的链由gp32(绿色)结合,引物通过Bst聚合酶(蓝色)延伸。两个引物结合/延伸最终产生一个完整的扩增拷贝。重复该过程导DNA指数扩增。(Piepenburg等,2006)